Citometría de flujo para el estudio de neoplasias hematológicas
Por: Dra. Vanessa Santiago Pacheco
Médica Patóloga, Laboratorio Clínico Hematológico S.A. Medellín, Colombia.
Publicado el 23-07-2021
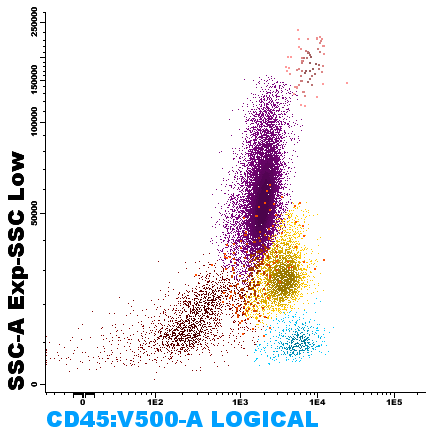
Figura 1. Visualización de poblaciones celulares en sangre medular, según su complejidad citoplasmática (SSC-A) y la expresión de CD45 (Antígeno común leucocitario).
La citometría de flujo es una herramienta rápida, confiable y económica para establecer el origen monotípico o politípico de una población celular, lo que permite su uso para valorar el compromiso medular por linfomas y otras enfermedades hematopoyéticas 7.
La inmunofenotipificación por citometría de flujo es un componente esencial en el diagnóstico de las leucemias agudas; permite la valoración rápida e integral de los antígenos de membrana e intracelulares relevantes expresados por las células leucémicas según su estado de maduración y progenie, lo que facilita la identificación y caracterización de los blastos, la asignación del linaje celular, la valoración de posibles blancos terapéuticos y la predicción de algunas alteraciones genéticas 8.
La sangre periférica y medular son las muestras más analizadas por citometría de flujo; sin embargo, cualquier tejido en el que puedan aislarse células individuales en suspensión puede ser analizado de esta manera, por ejemplo, el líquido cefalorraquídeo, pleural y ascítico 9, incluso muestras lisadas de tejidos sólidos como los ganglios linfáticos.
Aplicaciones
Este método de estudio ha sido empleado por más de 40 años en el diagnóstico y monitoreo de las neoplasias hematopoyéticas 2,3, a través del uso de anticuerpos monoclonales marcados con fluorocromos, que están dirigidos cada uno contra una molécula específica de la superficie, el citoplasma o el núcleo de los leucocitos y precursores hematopoyéticos 4. Los estudios iniciales se realizaban con anticuerpos individuales o con una combinación de dos anticuerpos, lo que limitaba la sensibilidad para detectar poblaciones celulares minoritarias. Con la disponibilidad de nuevos fluorocromos y tinciones, el análisis actual se hace de rutina con 8 a 12 anticuerpos diferentes en un solo tubo de muestra4,5,6.
Ventajas y limitaciones
El Laboratorio Clínico Hematológico en la clasificación de las neoplasias hematológicas
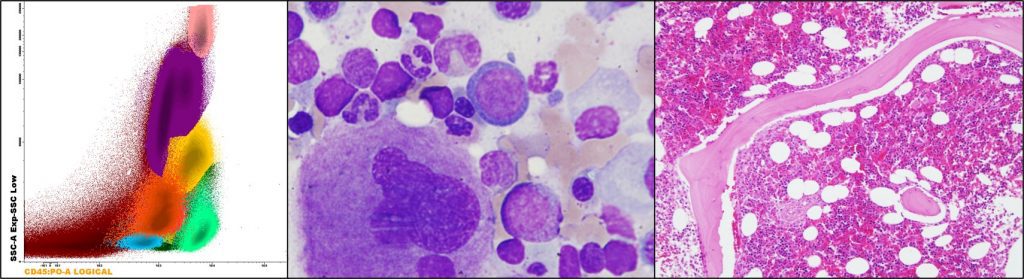
Figura 2. Poblaciones celulares en médula ósea, de izquierda a derecha: citometría de flujo, aspirado y biopsia.
Bibliografía
- BD Biociencias. Introducción a la citometría de flujo.pdf. BD Biociencias; 2005.
- Barlogie B, Latreille J, Freireich EJ, Fu CT, Mellard D, Meistrich M, et al. Characterization of hematologic malignancies by flow cytometry. Blood Cells. 1980;6(4):719-44.
- Bernstein ID, Andrews RG, Cohen SF, McMaster BE. Normal and malignant human myelocytic and monocytic cells identified by monoclonal antibodies. J Immunol Baltim Md 1950. febrero de 1982;128(2):876-81.
- van Dongen JJM, Lhermitte L, Böttcher S, Almeida J, van der Velden VHJ, Flores-Montero J, et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia. septiembre de 2012;26(9):1908-75.
- Hedley BD, Keeney M, Popma J, Chin-Yee I. Novel lymphocyte screening tube using dried monoclonal antibody reagents. Cytometry B Clin Cytom. diciembre de 2015;88(6):361-70.
- Rajab A, Axler O, Leung J, Wozniak M, Porwit A. Ten-color 15-antibody flow cytometry panel for immunophenotyping of lymphocyte population. Int J Lab Hematol. mayo de 2017;39 Suppl 1:76-85.
- Sorigue M, Cañamero E, Miljkovic MD. Systematic review of staging bone marrow involvement in B cell lymphoma by flow cytometry. Blood Rev. mayo de 2021;47:100778.
- DiGiuseppe JA, Wood BL. Applications of Flow Cytometric Immunophenotyping in the Diagnosis and Posttreatment Monitoring of B and T Lymphoblastic Leukemia/Lymphoma. Cytometry B Clin Cytom. julio de 2019;96(4):256-65.
- Cherian S, Hedley BD, Keeney M. Common flow cytometry pitfalls in diagnostic hematopathology. Cytometry B Clin Cytom. noviembre de 2019;96(6):449-63.
- van Dongen JJM, Orfao A, EuroFlow Consortium. EuroFlow: Resetting leukemia and lymphoma immunophenotyping. Basis for companion diagnostics and personalized medicine. Leukemia. septiembre de 2012;26(9):1899-907.



